研究報告:佐藤 浩央先生(群馬大学)
皆様こんにちは。2008年卒、気がつけば医師10年目の節目を迎えていました佐藤浩央です。
まずはご報告です。
2017年11月24日、私が1st author、群馬大学大学院医学系研究科・大学院教育研究支援センターの研究講師・柴田淳史先生がcorresponding authorで作成した論文 ”DNA double-strand break repair pathway regulates PD-L1 expression in cancer cells” が、Nature communications (最新Impact factor: 12.124)というオンラインジャーナルよりpublishされました。
少し話が逸れますが、この文章を読んでくれている学生の中には、“impact factor”という言葉に馴染みのない方も多いと思います(私も、大学院2年目くらいまで、何のことだか全く知りませんでした)ので、そこについて少し解説致します。
これは簡単に言うと「その雑誌が世界に与える影響度」を表す尺度です。つまり、impact factorが高い雑誌ほど世界に対する影響力が強く、雑誌のレベルも上がり、そして当然、論文掲載も難しくなる、ということになります。かなり乱暴に例えるなら、「週刊少年ジャンプ」はimpact factorが高く、「月刊近代盆栽」はimpact factorが低い、という感覚かも知れません(盆栽好きの方からの異論は受け付けます)。今回のNature communicationsは「週刊ヤングジャンプ」くらいではないか、と考えています(こちらも異論は受け付けます)。
話を戻します。
今回、メールマガジン編集部より「同門の先生と学生に向けて、Publishされた論文の内容と、それにまつわる裏話を」という執筆依頼を(締切の3日も前に)頂きましたので、その辺りについて書かせて頂きます。
なお、書き始めてみると思いの外長くなってしまいました。昼食後の休憩やコーヒーブレイクなどお時間のあるときに、お気軽にお読み頂ければと思います。
【研究内容について】
1.要約
今回の研究では、DNA二重鎖切断修復経路が腫瘍細胞のPD-L1発現に関与するメカニズムを明らかにしました。
2.背景
抗PD-1/PD-L1抗体が世界的な注目を集めていますが、その単独治療では20~40%の患者さんがProgressive diseaseであることが課題となっています。そこで、手術や化学療法、そして放射線治療といった従来のがん治療との併用に期待がかかっています。放射線治療との併用については、現在、世界で100を超える臨床試験が組まれている状況です。また併用療法の研究と同時に、抗PD-1/PD-L1抗体の効果予測因子についての研究も盛んに行われています。これまでの報告の中で、我々放射線腫瘍医にとって注目すべきポイントとしては、1) 放射線照射により、炎症生サイトカイン(IFNγなど)を介して腫瘍細胞のPD-L1発現が誘導されること、2) 腫瘍細胞表面のPD-L1発現が、抗PD-1/PD-L1抗体治療の予後予測因子のひとつとして考えられていること、3) 治療前検体のPD-L1高発現腫瘍は、低発現腫瘍よりも化学放射線治療に対する反応性が低いこと、が挙げられます。しかし、放射線によるDNA損傷とその修復経路が、PD-L1発現に関与するかについては明らかになっていませんでした。
3.結果
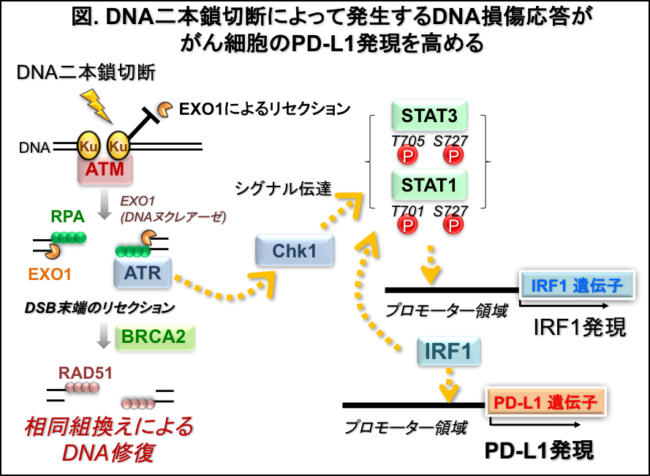
X線および重粒子線照射、さらにエトポシドやカンプトテシン等のDNA損傷系抗がん剤処理により、DNA損傷シグナルであるATM/ATR/Chk1依存的に、がん細胞のPD-L1発現上昇が引き起こされることを見出しました。さらにDNA二本鎖切断修復関連因子(39種)のsiRNAスクリーニングを行った結果、そのうちKu70/80、BRCA2、PALB2の3種のノックダウン細胞において、X線照射後のPD-L1発現誘導が増強することを見出しました。Ku80ノックダウン細胞におけるPD-L1発現亢進は、DNAヌクレアーゼであるEXO1/BLMを介したChk1活性化に依存していることを明らかにし、またBRCA2ノックダウン細胞ではPARP阻害剤処理によっても顕著にPD-L1発現が増強することを見出しました。それに加えて、DNA二重鎖切断が、これまで知られていた主要なPD-L1発現誘導経路であるSTAT1/3-IRF1経路を活性化することで、PD-L1の発現上昇を誘発することを明らかにしました。以上の結果から、DNA二重鎖切断発生後のDNA損傷シグナルが、がん細胞膜表面上のPD-L1発現上昇を誘発し、免疫反応制御に関わることが示唆されました(図)。これらの発見は、これまで未解明だったDNA損傷・修復からPD-L1発現までの分子機構についての理解を大きく広げました。
詳細な研究内容については、ぜひpublishされた論文をお読みください。
https://www.nature.com/articles/s41467-017-01883-9
【研究に関して】
・研究のはじまり
今回の研究のきっかけは、Corresponding authorである柴田先生との何気ない会話でした。私は自分の学位論文で、直腸癌検体で温熱化学放射線治療が腫瘍細胞のHLA class I発現を誘導することを報告していました。そして柴田先生は、DNA損傷修復に関する研究の第一人者です。それぞれのバックグラウンドを持ち寄ったところが、このプロジェクトの始まりでした。放射線腫瘍免疫をメインテーマとしていた臨床医の私と、DNA損傷修復に関する基礎研究を続けていた柴田先生の、まさにコラボレーションの結果となりました。
・実験
今回特に痛感したのは、レベルの高い雑誌からのリバイスの要求の高さです。初回投稿時と同量以上の実験を要求されました。(なお、聞くところによると、これでも少ない方とのことです。)
Impact factor 10点以上の雑誌に載せるチャンスなど(少なくとも私の人生においては)二度はないと思い、3月にリバイスが始まってからは、まさに人生をかけた研究生活でした。土曜以外は禁酒、土日祝日問わず約4か月間毎日実験や文献チェックを繰り返していました。それでも全く足りず、放射線科教室の大学院生や柴田研究室のメンバーにも実験を進めてもらう状況でした。
なお論文アクセプト後は、家族と夕食を取れる時間に帰ることも可能になっていますので、学生のみなさん、安心してください。
・柴田先生の指導
今回の研究は、これまでに何度もレベルの高い雑誌に論文を発表している、柴田先生のディレクションの賜物です。
指導の中で特に印象的だったのは、「必死にやる=寝ない」ではない、と言われたことです。実験のミスはそれだけで時間と物品を浪費することになるため、特に期限の限られているリバイスにおいては、常にベストな状態で臨むことが要求されます。そのため、4か月連勤中でも、三度の食事と最低5時間の睡眠を確保していました。安定して結果を出せなければ外される、プロスポーツ選手の心境に近いかも知れません。これまで何度も「一夜漬け」で乗り切ってきた私には、学ぶところの多い指導でした。
・頂いたサポート
強調したいのは、今回の論文作成において、直接・間接問わず本当に多くのサポートがなければ絶対にここまでたどり着けなかったことです。
現在は泌尿器科腫瘍チーム(通称黄色班)に属していますが、リバイス期間の4か月間は、臨床業務をほぼ全て、同チームの河村英将先生、久保亘輝先生、水上達治先生、安達彰子先生、岩永素太郎先生に分担して頂きました。さらに、実験は夜間にも及ぶため、病棟当直も、後輩の柴慎太郎先生、大西真弘先生、森康晶先生が代わってくれました。何より、研究内容の指導だけでなく、このような協力体制を構築し、私に十分な研究時間を与えてくれた、中野隆史教授、河村英将医会長、神沼拓也副医会長、先代ラボマネージャー尾池貴洋先生、そしてもちろん放射線科教室全員に心より感謝いたします。
・最後に
伊香保での中野教授就任10周年祝賀会で打ち上げられた「世界を代表する教室にする」「中野教授の名前をNatureに載せる」という目標のために、教室一丸となって取り組んだ、ひとつの結果であると思います。
医師がこのような研究を行えるのは、当教室の先輩方が築いてくださった歴史の積み重ねがあったからに他なりません。少なくとも日本国内の放射線腫瘍学教室に、ここまで生物研究を行える教室はないと思っています。そのような土壌に身を置く者として、そこに一つの結果を出せたことをとても嬉しく思います。
ここまで読んでくれた、(恐らくごくわずかな)学生の皆さんへメッセージです。
前の近況報告でも同じことを書きましたが、群大放射線科の先輩の言葉をもう一度書きます。「群大放射線科の最大の強みは、最新機器ではなく、日本で一番、教えてくれる先輩が多いこと」です。それに加え、あらゆる点でサポートし合える仲間がいます。医師10年目の私も、実に充実した毎日を過ごしております。
最後になりましたが、皆様からの引き続きのご指導を、よろしくお願い申し上げます。